Что такое мРНК
Жидкость, на которую возлагают большую надежду в борьбе против COVID-19, хранится в металлических контейнерах. Они находятся на производстве, которым владеет фирма Pfizer – сейчас один из лидеров по производству вакцин.
Читайте еще Взлет и падение AstraZeneca: ошибки, стоившие жизней людей
Внешне они ничем не выделяются среди других, но в них то, что стало первой вакциной против коронавируса в мире, писал в 2020 году Stat News. Pfizer, уже 171 год, сделали на это ставку стоимостью в 1 млрд долларов США.
Это же самое сделала младшая компания-соперница Moderna, которой всего 10 лет. Обе начали погоню за славой и деньгами. Pfizer работала вместе с малоизвестными немецкими фармацевтами BioNTech (они более чем год пытались соответствовать ожиданиям, но не получалось).
Какие бы разные не были подходы, генетическая технология была одна – мРНК. Она долго считалась многообещающей, но сталкивалась с препятствиями в биологическом мире. Полное ее название – синтетическая информационная РНК (рибонуклеиновая кислота – 24).
Матричная (или информационная) РНК
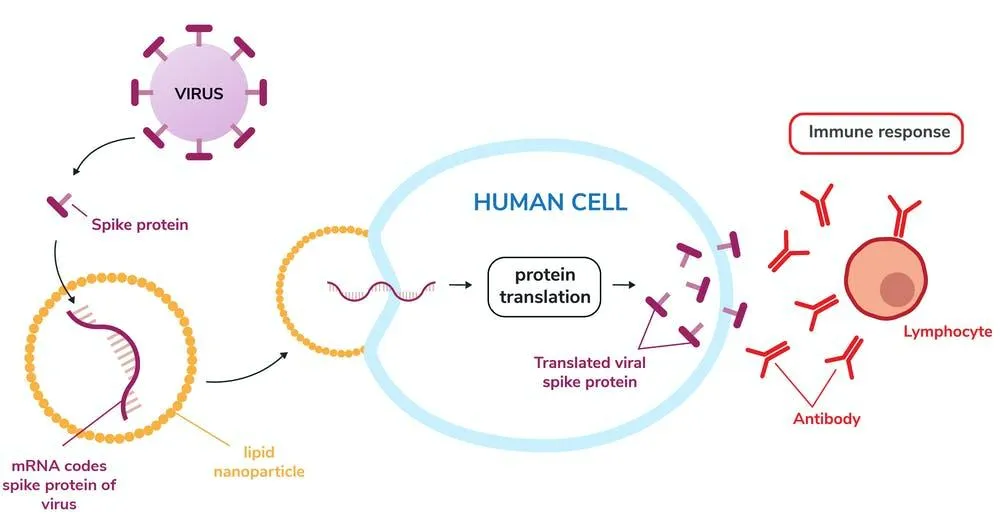
Отвечает за передачу "информации" от ДНК, как синтезировать, изменять и восстанавливать белки. После получения, клетки ее "считывают" и на этой основе конструируют собственные аминокислоты из протеинов. Сейчас ученые умеют делать мРНК, которые говорят клеткам вырабатывать конкретные протеины, похожие на те, что имеются в известных вирусах. На основе этой технологии, были созданы первые вакцины от коронавируса."РНК – большая молекула. Естественно, что она сама не может попасть в клетку. Поэтому вакцины на ее основе завернутые в наночастицы, которые отвечают, собственно, за доставку внутрь", – пояснил для сайта MIT Даниэль Андерсон, профессор химической инженерии в этом Институте.
Схема работы матричной РНК: создание протеина, в клетку, ответ / Графика The Conversation
В 1976 году было доказано: наночастицы из синтетических полимеров могут эффективно переносить крупные молекулы: белки и нуклеиновые кислоты. Позже Лангер, Андерсон и другие обнаружили жировые молекулы (липиды – 24), которые защищают молекулу РНК от расщепления в организме и помогают проходить клеточные мембраны. Moderna и Pfizer именно так "путешествуют" по организму.
После вакцинации протеины запускают защитную реакцию организма и выработку антител (а они в дальнейшем будут узнавать этот конкретный вирус – 24). Это позволяет иммунной системе засекать и уничтожать вирусы перед тем, как они вызовут заболевания. Более простыми словами: после укола, каждая клетка должна была быть превращена в "фабрику лекарств по требованию".
Впрочем, превратить обещание и мечту в реальность было гораздо сложнее. Несмотря на легкое производство, до последних лет ни одна вакцина или препарат с мРНК не получили одобрения. История началась 30 лет назад.
С конца тоннеля на свет: история идеи
Это сейчас мРНК – многомиллиардный бизнес, а тогда это был лишь тупик в карьере женщины Каталин Карико, которая родилась в Венгрии. И она провела 1990-е годы, собирая отказы и пытаясь доказать, что мРНК можно использовать для борьбы с болезнями.
Но идея была слишком надуманной для государственных грантов и финасов от корпоративного сектора; даже ее собственные коллеги не встали на сторону Карико. На бумаге все было правильно: мРНК передавала информацию клеткам, какие белки сейчас надо делать.
Затем эта технология уже работала на мышах благодаря исследователям из Университета Висконсина, но Карико хотела идти дальше. Проблема была в том, что мРНК была уязвимой к естественным защитным силам организма. То есть, она была бы уничтожена еще до того, как достигла бы цели. Хуже того, в последующем иммунном и биологическом хаосе организм может начать реагировать (подозревая, что это агрессивное заболевание – 24).
Хорошие новости Вакцинация снижает смертность от коронавируса на 95% : эксперимент из Бразилии
В этом случае, терапия может даже навредить пациенту. Мало кто разделял уверенность венгерки, что это можно решить. Она каждый вечер работала с грантами, но получала лишь "нет".
Каталин Корико в своем офисе / Фото STATNews
Она выросла и получила степень PhD в Венгрии, как пишет NYT. В Америку попала в 1985, когда венгерский грант закончился. Коммунистические власти разрешили семье взять лишь 100 долларов с собой, поэтому сотни фунтов стерлингов были зашиты в мишку дочери Сьюзен.
На американской работе тоже все было сложно: в 1995 ее даже понизили, не предоставив статус полного профессора в Пенсильвании. Она переходила из лаборатории в лабораторию, чтобы старший ученый взял ее к себе. Никогда не зарабатывая много.
Обычно люди просто прощаются и уходят, потому что это ужасно. Они ожидали, что я уйду,
– сказала Корико.
А муж застрял дома в Венгрии. Она действительно думала уйти из науки, но потом оглянулась и передумала: здесь есть все, что надо, нужны лишь лучшие эксперименты.
Со временем, это решение окупилось. Вместе с Дрю Вайсманом – иммунологом с медицинской степенью из Университета Бостона – Каталин нашла, как побороть "ахилесову пяту" мРНК.
Главная проблема
Естественно, каждая цепь мРНК состоит из четырех "строительных блоков" – нуклеозидов. Но в синтетической форме один из них был неправильным, как шина не подходящая колесу. И этот нуклеозид все разваливал, сигнализируя о вторжении якобы чего-то опасного.В ответ, Карико и Вайсман создали "гибридную мРНК", позволявшую ей дойти до клеток, не активируя абсолютно всю безопасность тела. Ученые назвали процесс "заменой шины". Другая аналогия – ограбление без включения сигнализации. "Я чувствовала себя Богом", – призналась Каталин. Этот генетический сценарий позволял делать любые белки по желанию.
Это было ключевое открытие. Они поняли, что если включить модифицированные нуклеозиды в мРНК, вы сможете убить двух зайцев,
– пояснил STAT Норберт Парди, доцент кафедры медицины в Пенсильвании, частый помощник двух ученых.
Впрочем, лишь в 2005 году и далее оно было описано в серии научных работ. Карико и Вайсман сохраняли веру и именно это стало стартовой площадкой для производства вакцин. Несмотря на то, что новости прошли в основном вне радара, они привлекли внимание двух людей в науке.
Рождение Moderna
Первым откликнулся канадец Деррик Росси из Торонто. Он именно был 39-летним докторантом, который исследовал стволовые клетки в 2005. И тогда и сейчас он сказал, что оба – венгерка и американец – заслуживают Нобелевской премии по химии. "Это фундаментальное открытие, которое поможет миру сделать лекарство", – сказал он STAT.
Он взял мРНК в свои исследования стволовых клеток эмбрионов в 2007. Когда уже стал ассистентом профессора в медицинской школе Гарварда. Эти клетки были еще более невероятными: благодаря процессу, который называли "биологическая алхимия" (научное название – потентность – 24), они могли преобразиться.. на любой тип клеток в организме! Это дало бы ключ к лечению сложных случаев: от заболеваний спинного мозга до болезни Паркинсона.
Впрочем, с этической точки зрения, их использование (а берут их из абортированных эмбрионов) вызывало и до сих пор вызывает огненную бурю. Возможно, и здесь мРНК могла бы помочь. Например, эти "молекулы-посланники" перепрограммировали бы взрослые клетки, чтобы они действовали как эмбриональные стволовые.
Деррик Росси развил идеи на стволовых клетках / Фото University of Toronto
Идея требовала более чем года работы, первые результаты поступили в 2009. Клетки были успешно созданы.
Росси сразу, волнуясь, сообщил своему коллеге из Гарварда Тимоти Спрингеру. Кроме научной работы, тот был еще и предпринимателем в области биотехнологий. Он подключил профессора биоинженерии из Массачусетского Технологического Института (знаменитого MИT – 24), легендарного Роберта Лангера. Он был еще и плодовитым изобретателем. В 2010 году, троица собралась вместе в Кембридже.
У Лангера более 400 патентов на лекарства, он был лауреатом премии Чарльза Старка Дрейпера – что-то вроде "Нобелевки для инженеров". Слушая Росси, ученый понимал – это больше, чем просто открытие. Но он сам признает: в 1970-х годах, когда появились первые работы про матричную РНК, "все это было очень противоречиво. Все говорили, что у нас ничего не получится. Мои 9 грантов были отклонены".
"Маскировка" мРНК для проникновения в клетки для производства белков давало "потрясающее число применений, которые могут спасти миллионы жизней", – сказал он.
Я думаю, вы смогли бы сделать гораздо больше, чем стволовые клетки. Вакцины, лекарства, вот это все,
– вынес этот почтенный человек свой вердикт
Через три дня Росси уже презентовал идею для венчурных предприятий, включая Кембриджскую фирму венчурного капитала Нубара Афеяна. Там тоже ждал успех и интерес. Так на свет появилась Moderna – новая фармакологическая компания.
Победа уже рядом Новый препарат блокирует самые агрессивные штаммы коронавируса
Впрочем, даже на заработанные сотни миллионов долларов США, отношения между Лангером, Росси и Афеяном со временем серьезно ухудшились. Росси ушел из Moderna в 2014. Афеян остался ее главой. Значительно позже, он признал, что Росси продвигал работу ученых из Пенсильвании. Но теперь он хотел большего: "создать молекулу, которая могла бы изменить абсолютно все в организме".
BioNTech: фирма иммигрантов
Город Майнц лежит на левом берегу реки Рейн в Германии. Там тоже рассматривали мРНК, как потенциальную революцию. В Майнце базировалась до последних времен малоизвестная компания BioNTech, основанная двумя иммигрантами из Турции, супружеской парой.
Угур Шахин переехал, потому что его отец получил работу на заводе Ford в Германии. Жена, Йозлем Тюречи, в детстве ходила к отцу-хирургу в католическую больницу. Пара познакомилась, работая в больнице в области Саар в 1990 году. Оба стали врачами и интересовались иммунотерапией для борьбы с онкологиями.
Обратите внимание Израиль проверяет возможные связи между вакциной Pfizer и случаями миокардита
Их интересовала возможность создания персонализированных вакцин, которые бы обучали иммунную систему находить и удалять раковые клетки. Они нашли инвесторов и себе: братьев Струнгманов, Томаса и Андреаса. Новая компания BioNTech в презентации обещала работать над вакциной против рака. Штаб-квартира сейчас находится в Кембридже, США.
Супруги основателей фирмы BioNTech / Коллаж FT
"Мы не считаем себя компанией, которая просто передает РНК. Мы занимаемся иммунотерапией", – сказал Сахин, также профессор в Медицинской школе Майнцу. Устои технологии заложили все те же Карико и Вайсман. Но их работа долго игнорировалась, потому что они не смогли найти себе инвестора.
2013 году, Каталин присоединилась к BioNTech, как старший вице-президент, чтобы контролировать исследования с мРНК.
Различные пути к победе
Итак, две компании были созданы, но шли к успеху разными путями.
Moderna наняла молодую звезду, как гендиректора – инженера-химика Стефана Банселя. Он "олицетворял агрессивный подход к биотехнологическому бизнесу", имея также MBA из Гарварда. До этого, Бансель возглавлял французскую фирму BioMérieux, которая занималась диагностикой.
На старте, Moderna собрала под 300 млн долларов США на препараты, которых еще не существовало в природе. Включая 240 млн от AstraZeneca. Всего – 2 млрд долларов США инвестиций до 2018 года. Далее она стала публичной компанией на бирже.
Более низкая доза оказалась слабой. Это стало временным падением для Moderna. Там сосредоточились на производстве вакцин, отложив свои эксприментальные тесты на второй план. Впрочем, достигнув в этом значительных успехов (вся остальная "фарма" до сих пор считает, что на вакцинах денег не заработаешь).
Та же история с BioNTech – полная уверенность инвесторов почти без доказательств. Только опыт и находки, "которые изменят мир". Но, в отличие от хайпа Moderna, Шахин и его жена работали первые 5 лет "будто под водой", не привлекая внимания. За последние восемь лет, опубликовали 150 научных работ.
Актуально CDC опубликовал отчет о случаях заражений COVID-19 после вакцинации
С 2013 года начали разрабатывать до уровня клинических испытаний несколько соединений для лечения рака. Пока, ни одна еще не утверждена. BioNTech тоже стала публичной компанией, но стоила вполовину дешевле чем Moderna – 3,4 млрд долларов США.
В конце 2019 года, мир изменился. Хотя ученые уже имели опыт, потому что это не первая коронавирусная эпидемия на планете. Две вспышки в 2000-х годах дали много важной информации.
Гонка за вакциной
30 декабря 2019 года Международное общество по инфекционным болезням из Массачусетса, США, опубликовало на своем сайте тревожное сообщение. У ряда людей в Ухане, китайском городе из более 11 млн жителей, был поставлен диагноз "необъяснимая пневмония". Потом их стало уже 41 и все были в больнице.
Китайские ученые 10 января 2020 года выложили генетическую последовательность вируса в сеть. Компаниям, работающим с мРНК, сам вирус ни к чему. Нужна лишь программа, которая строит последовательность нужных химических веществ. Moderna и BioNTech взглянули друг на друга. Гонка за вакциной началась, потому что надвигалась пандемия.
Был разработан кусок генетического кода, который можно было ввести в клетки для стимуляции иммунного ответа. Две вакцины несмотря на общую основу имеют отличия: в химической структуре, способе образования и доставки веществ. Обе требуют двух инъекций с интервалом в несколько недель. Другие – такие как CoronaVac – содержали инактивированный вирус, но это более сложный способ.
Moderna выиграла гонку, первой представив вакцину от COVID-19 / Фото The Verge
24 февраля Moderna первой отправила сотни флаконов с экспериментальной вакциной в Бетесду, штат Миссисипи. Там находится Национальный Институт аллергии и инфекционных болезней. Они выиграли спринт, первыми тестировали на людях.
Май компания встретила пресс-релизом о "положительных промежуточных клинических данных". То есть, они сумели сгенерировать антитела, нейтрализующие SARS-CoV-2 у восьми добровольцев на раннем этапе. Позже, с другой технологией (которая требует лишь один укол – 24) к разработке присоединилась и Johnson&Johnson.
BioNTech действовал медленнее, там изначально хотели лишь защитить Германию от пандемии. Партнером в этом выступила фирма Pfizer после переговоров Шахина и "королевы вакцин" Pfizer Катрин Янсен.
Которая, кстати, тоже проходила через скептицизм научных кругов, но получала результаты. Завод в Андовере, где работало около 1400 работников, начал работать на полную мощность. Цена вопроса – почти 2 млрд долларов США за первые 100 млн доз.
Для бедных стран без специальной инфраструктуры, есть один важный факт: мРНК вакцина самоуничтожается при высоких температурах. Pfizer нужно хранить при -70 градусах по Цельсию, вакцину Moderna – при -20 по Цельсию. Если же привлечь процесс лиофилизации, то их можно будет хранить в холодильнике, а не в морозильной камере.
Лиофилизация
Технический процесс добавления к вакцине стабилизаторов и удаления из нее воды, чтобы облегчить условия храненияПосле коронавируса: на что еще способна мРНК
Уже сейчас ученые на волне успеха вакцин на основе матричной РНК, думают, как использовать ее уже после пандемии.
Ноябрь 2020 года. Главный инфекционист США Энтони Фаучи получил новости, что третья фаза клинических испытаний Pfizer и Moderna показали 90% эффективности. Он не имел слов и прислал журналисту смайлик вместо комментария, пишет CNN. Технология, на которую делали ставки десятки лет, окупается сторицей.
Карико и Вайсман в настоящее время имеют пять вакцин на первой фазе клинических испытаний, но их исследование было приостановлено пандемией.
Вакцины
- Две вакцины направлены на грипп, одна из них может стать универсальной. То есть такой, которая один раз и на всю жизнь защитит человека от мутирующих штаммов болезни (это же теперь касается и вакцины против ковида – 24). Устраняя необходимость вакцинации каждый год. Еще две – против ВИЧ (вирус иммунодефицита человека, вызывающий СПИД – 24) и генитального герпеса.
- Другие респираторные болезни также потенциально важнейшие мишени. К примеру, РСВ (респираторно-синцитиальный вирус), туберкулез, человеческий метапневмовирус (вызывает пневмонию). РСВ инфицирует или детей или пожилых людей и может приводить к бронхитам. Младенцев РСВ способен вложить в интенсивную терапию новорожденных, а ежегодно убивает 100-500 детей и 14000 взрослых.
- Ранее изучались вакцины на основе мРНК против тропических лихорадок Эболы и Зика, а также бешенства и цитомегаловируса. В более далеких планах – малярия, вирус Нипах (редкая энцефалитная болезнь, передается от свиней – 24).
Борьба с раком
Наш организм борется с раком каждый день и мРНК может помочь ему делать это еще лучше. То есть так можно заставить тело вырабатывать полезные молекулы.
Представьте: вам уколят мРНК, которая кодирует антитела против одного конкретного рецептора,
– пояснил CNN структурный биолог Джейсон Маклеллан.
В Moderna рассказали, как продвигается работа на этом направлении. "Мы обнаруживаем мутации на раковых клетках пациента. Затем создаем вакцину, которая направлена на каждую из них отдельно и грузим ее в одну молекулу РНК", – говорит компания на сайте. Всего сейчас известно около 20 мутаций.
Больше по теме Вакцина против вируса, вызывающего рак, оказалась намного эффективнее
После этого этот "коктейль" вводят пациенту, чтобы спровоцировать иммунный ответ. Пока что это ранние клинические испытания фазы один.
Генная терапия
Идея генной терапии заключается в изменении дефектного гена на тот, который работает должным образом. Исследователи пока не могут похвастаться значительными успехами. Труднее всего найти вектор для переноса правильного гена в клетку, не вызывая побочных эффектов.
Но способность мРНК свободно перемещаться по организму может решить эту проблему. Вайсман видит особую перспективу в лечении таким образом серповидноклеточной анемии. При ней красные кровяные тельца – эритроциты – имеют вид серпа. Они могут закупоривать маленькие кровеносные сосуды, вызывая боль и повреждение органов.
Матричная РНК может отправлять "новые инструкции" в костный мозг, говоря им делать клетки здоровыми. "Мы сможем сделать одну внутривенную инъекцию мРНК, нацеленную на стволовые клетки костного мозга и исправить это заболевание, – говорит ученый. – Генная терапия без цены в полмиллиона долларов! "
Тесты на мышах показали эффективность, далее – тесты на обезьянах. В 2008 году ученые взялись за (очередное – 24) лечение муковисцидоза. Это смертельная генетическая болезнь, вызванная маленькой мутацией гена CFTR. Сейчас этим занимается компания Translate Bio, которая тоже использует мРНК. Технология такова: доставка РНК к гену с помощью небулайзера.
Небулайзер
Прибор для ингаляционной доставки лекарства в виде тумана в легкие. Производит частицы меньше 5 микрон в диаметре. Используется при астме, респираторных болезнях и в других случаяхЭто лечение уже получило одобрение от Американской администрации по вопросам пищевых продуктов и медикаментов для лечения редких заболеваний (так называемых орфанным). Скорее всего, это лишь начало новой эры в медицине и биологии. Но путь к ней был долгим и полным лишений.