Що таке мРНК
Рідина, на яку покладають велику надію у боротьбі проти COVID-19, зберігається в металевих контейнерах. Вони знаходяться на виробництві, яким володіє фірма Pfizer – зараз один з лідерів з виробництва вакцин.
Читайте ще Зліт та падіння AstraZeneca: помилки, що коштували життів людей
Ззовні вони нічим не виділяються серед інших, але в них те, що стало першою вакциною проти коронавірусу у світі, писав у 2020 році Stat News. Pfizer, вже 171 рік, зробили на це ставку вартістю у 1 млрд доларів США.
Це ж саме зробила молодша компанія-суперниця Moderna, якій лише 10 років. Обидві почали гонитву за славою та грошима. Pfizer працювала разом з маловідомими німецькими фармацевтами BioNTech (вони більш ніж рік намагалися відповідати очікуванням, але не виходило).
Хай які різні були підходи, генетична технологія була одна – мРНК. Вона довго вважалася багатообіцяючою, але стикалася з перешкодами у біологічному світі. Повна її назва – синтетична інформаційна РНК (рибонуклеїнова кислота – 24).
Матрична (або інформаційна) РНК
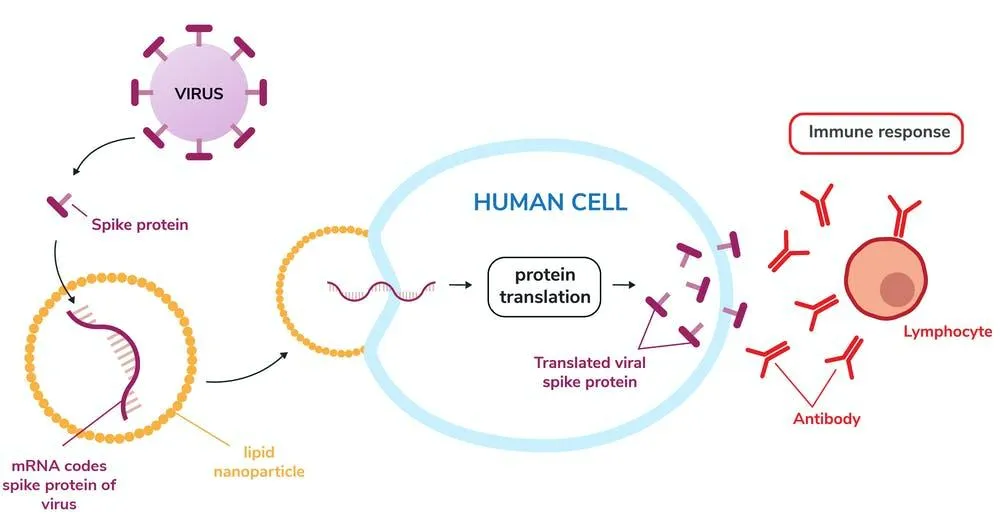
Відповідає за передачу "інформації" від ДНК, як синтезувати, змінювати та відновлювати білки. Після отримання, клітини її "зчитують" та на цій основі конструюють власні амінокислоти з протеїнів. Наразі, вчені вміють робити мРНК, які кажуть клітинам виробляти конкретні протеїни, схожі на ті, що наявні у відомих вірусах. На основі цієї технології, були створені перші вакцини від коронавірусу"РНК – це велика молекула. Природньо, що вона сама не може потрапити в клітину. Тому вакцини на її основі загорнуті у наночастинки, які відповідають, власне, за доставку всередину", – пояснив для сайту MIT Даніель Андерсон, професор хімічної інженерії у цьому Інституті.
Схема роботи матричної РНК: створення протеїну, в клітину, відповідь / Графіка The Conversation
У 1976 році було доведено: наночастинки з синтетичних полімерів можуть ефективно переносити великі молекули: білки та нуклеїнові кислоти. Пізніше, Лангер, Андерсон та інші відкрили жирові молекули (ліпіди – 24), які захищають РНК-молекулу від розщеплення в організмі та допомогають проходити клітинні мембрани. Moderna та Pfizer саме так "подорожують" організмом.
Після вакцинації протеїни запускають захисну реакцію організму та вироблення антитіл (а вони надалі будуть впізнавати цей конкретний вірус –24). Це дає змогу імунній системі засікати та знищувати віруси перед тим, як вони викличуть захворювання. Простішими словами: після уколу, кожна клітина мала бути перетворена на "фабрику ліків на вимогу".
Втім, перетворити обіцянку та мрію у реальність було набагато складніше. Попри легке виробництво, до останніх років жодна вакцина чи препарат з мРНК не здобув схвалення. Історія почалася 30 років тому.
З кінця тунелю на світло: історія ідеї
Це зараз мРНК – багатомільярдний бізнес, а тоді це був лише глухий кут у кар'єрі жінки Каталін Каріко, яка народилась в Угорщині. І вона провела 1990-ті роки, збираючи відмови і намагаючись довести, що мРНК можна використовувати для боротьби з хворобами.
Але ідея була занадто надуманою для державних грантів та фінансів від корпоративного сектору; навіть її власні колеги не встали на бік Каріко. На папері все було правильно: мРНК передавала інформацію клітинам, які білки зараз треба робити.
Тоді, ця технологія вже працювала на мишах завдяки дослідникам з Університету Вісконсину, але Каріко хотіла йти далі. Проблема була у тому, що мРНК була вразливою до природних захисних сил організму. Тобто, вона була б знищена ще до того, як досягла б мети. Що ще гірше, у подальшому імунно-біологічному хаосі, організм може почати відповідати (підозрюючи, що це агресивне захворювання – 24).
Гарні новини Вакцинація знижує смертність від коронавірусу на 95%: експеримент з Бразилії
В цьому випадку, терапія може навіть зашкодити пацієнту. Мало хто поділяв впевненість угорки, що це можна вирішити. Вона кожен вечір працювала з грантами, але отримувала лише "ні".
Каталін Коріко у своєму офісі / Фото STATNews
Вона виросла та здобула ступінь PhD в Угорщині, як пише NYT. До Америки потрапила у 1985, коли угорський грант закінчився. Комуністична влада дозволила родині взяти лише 100 доларів з собою, тож сотні фунтів стерлінгів були зашиті у ведмедика дочки Сьюзен.
На американській роботі теж все було складно: у 1995 її навіть понизили, не надавши статус повного професора у Пенсильванії. Вона переходила з лабораторії до лабораторії, щоб старший вчений взяв її до себе. Ніколи не заробляючи багато.
Зазвичай, люди просто прощаються і йдуть, бо це жахливо. Вони очікували, що я піду,
– сказала Коріко.
А чоловік застряг вдома в Угорщині. Вона дійсно думала піти з науки, але потім роззирнулася та передумала: тут є все, що треба, потрібні лише кращі експерименти.
З часом, це рішення окупилося. Разом з Дрю Вайсманом – імунологом з медичним ступенем з Університету Бостону – Каталін знайшла, як побороти "ахілесову п'яту" мРНК.
Головна проблема
Природньо, кожний ланцюг мРНК складається з чотирьох "будівельних блоків" – нуклеозидів. Але у синтетичній формі, один з них був неправильним, як шина, що не підходить колесу. І цей нуклеозид все розвалював, сигналізуючи організм про вторгнення нібито чогось небезпечного.У відповідь, Каріко та Вайсман створили "гібридну мРНК", що дозволяла їй дійти до клітин, не активуючи абсолютно всю безпеку тіла. Вчені назвали процес "заміною шини". Інша аналогія – пограбування без увімкнення сигналізації. "Я почувала себе Богом", – зізналася Каталін. Цей генетичний сценарій давав змогу робити будь-які білки за бажанням.
Це було ключове відкриття. Вони зрозуміли, що якщо включити модифіковані нуклеозиди в мРНК, ви зможете вбити двох зайців,
– пояснив STAT Норберт Парді, доцент кафедри медицини в Пенсильванії, частий помічник двох вчених.
Втім, лише у 2005 році і далі воно було описано у серії наукових робіт. Каріко та Вайсман зберігали віру і саме це стало стартовим майданчиком для виробництва вакцин. Попри те, що новини пройшли здебільшого поза радаром, вони привернули увагу двох людей в науці.
Народження Moderna
Першим відгукнувся канадець Деррік Россі з Торонто. Він саме був 39-річним докторантом, який досліджував стовбурові клітини в 2005. І тоді і зараз він сказав, що обидва – угорка та американець – заслуговують Нобелівської премії з хімії. "Це фундаментальне відкриття, яке допоможе світові робити ліки", – сказав він STAT.
Він взяв мРНК у свої дослідження стовбурових клітин ембріонів у 2007. Коли вже став асистентом професора у медичній школі Гарварду. Ці клітини були ще більш неймовірними: завдяки процесу, який називали "біологічна алхімія"(наукова назва – потентність – 24), вони могли перетворитися..на будь-який тип клітин в організмі! Це дало б ключ до лікування складних випадків: від захворювань спинного мозку до хвороби Паркінсона.
Втім, з етичної точки зору, їхнє використання (а беруть їх з абортованих ембріонів) викликало та й досі викликає вогняну бурю. Можливо, і тут мРНК могла б допомогти. Наприклад, ці "молекули-посланці" перепрограмовували би дорослі клітини, щоб вони діяли як ембріональні стовбурові.
Деррік Россі розвинув ідеї на стовбурових клітинах / Фото University of Toronto
Ідея потребувала більш ніж року роботи, перші результати надійшли у 2009. Клітини були успішно створені.
Россі відразу, хвилюючись, повідомив свого колегу з Гарварду Тімоті Спрінгера. Окрім наукової роботи, той був ще й підприємцем у галузі біотехнологій. Він підключив професора біоінженерії з Массачусетського Технологічного Інституту (знаменитого MIT – 24), легендарного Роберта Лангера. Він був ще й плодовитим винахідником. У 2010 році, трійця зібралася разом у Кембриджі.
У Лангера понад 400 патентів на ліки, він був лауреатом премії Чарльза Старка Дрейпера – щось на кшталт "Нобелівки для інженерів". Слухаючи Россі, вчений розумів – це більше, ніж просто відкриття. Але він сам визнає: у 1970-х роках, коли з'явилися перші роботи про матричну РНК, "все це було дуже суперечливо. Всі казали, що в нас нічого не вийде. Мої 9 грантів були відхилені".
"Маскування" мРНК для проникнення в клітини для виробництва білків давало "приголомшливе число застосувань, які можуть врятувати мільйони життів", – сказав він.
Я думаю, ви змогли б зробити набагато більше, ніж стовбурові клітини. Вакцини, ліки, ось це все,
– виніс цей поважний чоловік свій вердикт
Через три дні Россі вже презентував ідею для венчурних підприємств, включаючи Кембриджську фірму венчурного капіталу Нубара Афеяна. Там теж чекав успіх та зацікавлення. Так на світ з'явилася Moderna – нова фармакологічна компанія.
Перемога вже близько Новий препарат блокує найагресивніші штами коронавірусу
Втім, навіть на зароблені сотні мільйонів доларів США, стосунки між Лангером, Россі та Афеяном з часом серйозно погіршились. Россі пішов з Moderna у 2014. Афеян залишився її головою. Значно пізніше, він визнав, що Россі просував роботу вчених з Пенсильванії. Але тепер він хотів більшого: "створити молекулу, яка могла б змінити абсолютно все в організмі".
BioNTech: фірма мігрантів
Місто Майнц лежить на лівому березі річки Рейн в Німеччині. Там теж розглядали мРНК як потенційну революцію. У Майнці базувалася до останніх часів маловідома компанія BioNTech, заснована двома імігрантами з Туреччини, одруженою парою.
Угур Шахін переїхав, бо його батько отримав роботу на заводі Ford в Німеччині. Дружина, Йозлем Тюречі, у дитинстві ходила до батька-хірурга у католицьку лікарню. Пара познайомилася, працюючи в лікарні в області Саар у 1990 році. Обидва стали лікарями і цікавилися імунотерапією для боротьби з онкологіями.
Зверніть увагу Ізраїль перевіряє можливі зв’язки між вакциною Pfizer і випадками міокардиту
Їх цікавила можливість створення персоналізованих вакцин, які б навчали імунну систему знаходити та видаляти ракові клітини. Вони знайшли інвесторів і собі: братів Струнгманів, Томаса та Андреаса. Нова компанія BioNTech у презентації обіцяла працювати над вакциною проти раку. Штаб-квартира зараз знаходиться у Кембриджі, США.
Подружжя засновників фірми BioNTech / Колаж FT
"Ми не вважаємо себе компанією, яка просто передає РНК. Ми займаємось імунотерапією", – сказав Сахін, також професор у медичній школі Майнцу. Підвалини технології заклали все ті ж Каріко та Вайсман. Але їхня робота довго ігнорувалася, бо вони не змогли знайти собі інвестора.
2013 році, Каталін приєдналася до BioNTech як старший віцепрезидент, щоб контролювати дослідження з мРНК.
Різні шляхи до перемоги
Отже, дві компанії були створені, але йшли до успіху різними шляхами.
Moderna найняла молоду зірку, як гендиректора – інженера-хіміка Стефана Банселя. Він "уособлював агресивний підхід до біотехнологічного бізнесу", маючи також MBA з Гарварду. До цього, Бансель очолював французську фірму BioMérieux, яка займалася діагностикою.
На старті, Moderna зібрала під 300 млн доларів США на препарати, яких ще не існувало в природі. Включаючи 240 млн від AstraZeneca. Загалом – 2 млрд доларів США інвестицій до 2018 року. Далі вона стала публічною компанією на біржі.
Нижча доза виявилася заслабкою. Це стало тимчасовим падінням для Moderna. Там зосередились на виробництві вакцин, відклавши свої експериментальні тести на другий план. Втім, досягнувши у цьому значних успіхів (вся інша "фарма" досі вважає, що на вакцинах грошей не заробиш).
Та сама історія з BioNTech – повна впевненість інвесторів майже без доказів. Лише досвід та знахідки, "що змінять світ". Але, на відміну від хайпу Moderna, Шахін та його дружина працювали перші 5 років "ніби під водою", не привертаючи уваги. За останні вісім років, опублікували 150 наукових робіт.
Актуально CDC опублікував звіт про випадки заражень COVID-19 після вакцинації
З 2013 року, почали розробляти до рівня клінічних випробувань кілька сполук для лікування раку. Наразі, жодна ще не затверджена. BioNTech теж стала публічною компанією, але коштувала вполовину дешевше ніж Moderna – 3,4 млрд доларів США.
Наприкінці 2019 року, світ змінився. Хоча вчені вже мали досвід, бо це не перша коронавірусна епідемія на планеті. Два спалахи у 2000-х роках дали багато важливої інформації.
Гонитва за вакциною
30 грудня 2019 року Міжнародне товариство з інфекційних хвороб з Массачусетса, США, опублікувало на своєму сайті тривожне повідомлення. У ряду людей в Ухані, китайському місті з понад 11 млн жителів, був поставлений діагноз "незрозуміла пневмонія". Потім їх стало вже 41 і всі були в лікарні.
Китайські вчені 10 січня 2020 виклали генетичну послідовність вірусу в Мережу. Компаніям, що працюють з мРНК, сам вірус ні до чого. Потрібна лише програма, яка будує послідовність потрібних хімічних речовин. Moderna та BioNTech поглянули одна на одну. Гонитва до вакцини почалась, бо насувалася пандемія.
Був розроблений шматок генетичного коду, який можна було ввести в клітини для стимуляції імунної відповіді. Дві вакцини попри спільну основу мають відмінності: у хімічній структурі, способі утворення та доставки речовин. Обидві вимагають двох ін'єкцій з інтервалом у кілька тижнів. Інші – такі як CoronaVac – містили інактивований вірус, але це більш складний спосіб.
Moderna виграла перегони, першою представивши вакцину від COVID-19 / Фото The Verge
24 лютого Moderna першою відправила сотні флаконів з експериментальною вакциною в Бетесду, штат Міссісіпі. Там знаходиться Національний Інститут алергії та інфекційних хвороб. Вони виграли спринт, першими тестували на людях.
Травень компанія зустріла пресрелізом про "позитивні проміжні клінічні дані". Тобто, вони зуміли згенерувати антитіла, що нейтралізують SARS-CoV-2 у восьми добровольців на ранньому етапі. Пізніше, з іншою технологією (яка вимагає лише один укол – 24) до розробки приєдналася й Johnson&Johnson.
BioNTech діяв повільніше, там спочатку хотіли лише захистити Німеччину від пандемії. Партнером у цьому виступила фірма Pfizer після перемовин Шахіна та "королеви вакцин" Pfizer Катрін Янсен.
Яка, до речі, теж проходила через скептицизм наукових кіл, але здобувала результати. Завод в Андовері, де працювало близько 1400 працівників, почав працювати на повну потужність. Ціна питання – майже 2 млрд доларів США за перші 100 млн доз.
Для бідних країн без спеціальної інфраструктури, є один важливий факт: мРНК вакцина самознищується за високих температур. Pfizer потрібно зберігати при -70 градусах за Цельсієм, вакцину Moderna – при -20 за Цельсієм. Якщо ж залучити процес ліофілізації, то їх можна буде зберігати у холодильнику, а не в морозильній камері.
Ліофілізація
Технічний процес додавання до вакцини стабілізаторів та видалення з неї води, щоб полегшити умови зберіганняПісля коронавірусу: на що ще здатна мРНК
Вже зараз вчені на хвилі успіху вакцин на основі матричної РНК, думають, як використати її вже після пандемії.
Листопад 2020 року. Головний інфекціоніст США Ентоні Фаучі отримав новини, що третя фаза клінічних випробувань Pfizer та Moderna показали 90% ефективності. Він не мав слів і надіслав журналісту смайлик замість коментаря, пише CNN. Технологія, на яку робили ставки десятки років, окупається зповна.
Каріко та Вайсман наразі мають п'ять вакцин на першій фазі клінічних випробувань, але їхнє дослідження було призупинене пандемією.
Вакцини
- Дві вакцини спрямовані на грип, одна з них може стати універсальною. Тобто такою, яка один раз і на все життя захистить людину від мутуючих штамів хвороби (це ж тепер стосується і вакцини проти ковіду – 24). Усуваючи необхідність вакцинації кожного року. Ще дві – проти ВІЛ (вірус імунодефіциту людини, що викликає СНІД – 24) та генітального герпесу.
- Інші респіраторні хвороби також потенційно найважливіші мішені. До прикладу, РСВ (респіраторно-синцитіальний вірус), туберкульоз, людський метапневмовірус (викликає пневмонію). РСВ інфікує або дітей або людей похилого віку і може призводити до бронхітів. Немовлят РСВ здатний вкласти у інтенсивну терапію новонароджених, а щорічно вбиває 100-500 дітей і 14000 дорослих.
- Раніше вивчалися вакцини на основі мРНК проти тропічниї лихоманок Еболи і Зіка, а також сказу та цитомегаловірусу. У більш далеких планах – малярія, вірус Ніпах (рідкісна енцефалітна хвороба, передається від свиней – 24).
Боротьба з раком
Наш організм бореться з раком кожного дня і мРНК може допомогти йому робити це ще краще. Тобто так можна змусити тіло виробляти корисні молекули.
Уявіть: вам вколять мРНК, яка кодує антитіла проти одного конкретного рецептору,
– пояснив CNN структурний біолог Джейсон Маклеллан.
В Moderna розповіли, як просувається робота на цьому напрямку. "Ми виявляємо мутації на ракових клітинах пацієнта. Потім створюємо вакцину, яка направлена на кожну з них окремо і вантажимо її у одну молекулу РНК", – каже компанія на сайті. Всього наразі відомо близько 20 мутацій.
Більше з теми Вакцина проти вірусу, який викликає рак, виявилася набагато ефективнішою
Після цього цей "коктейль" вводять пацієнту, щоб спровокувати імунну відповідь. Поки що це ранні клінічні випробування фази один.
Генна терапія
Ідея генної терапії полягає у зміні дефектного гену на такий, що працює належним чином. Дослідники поки не можуть похизуватися значними успіхами. Найважче знайти вектор для перенесення правильного гена в клітину, не викликаючи побічних ефектів.
Але здатність мРНК вільно пересуватись організмом може вирішити цю проблему. Вайсман бачить особливу перспективу у лікуванні таким чином серповидноклітинної анемії. При ній, червоні кров'яні тільця – еритроцити – мають вигляд серпа. Вони можуть закупорювати маленькі кровоносні судини, викликаючи біль та пошкодження органів.
Матрична РНК може надсилати "нові інструкції" до кісткового мозку, кажучи їм робити клітини здоровими. "Ми зможемо зробити одну внутрішньовенну ін'єкцію мРНК, націлену на стовбурові клітини кісткового мозку та виправити це захворювання, – каже вчений. – Генна терапія без ціни у півмільона доларів! "
Тести на мишах показали ефективність, далі – тести на мавпах. У 2008 році вчені взялися за (чергове – 24) лікування муковісцидозу. Це смертельна генетична хвороба, спричинена маленькою мутацією гену CFTR. Зараз цим займається компанія Translate Bio, яка теж використовує мРНК. Технологія така: доставка РНК до гену за допомогою небулайзеру.
Небулайзер
Прилад для інгаляційної доставки ліків у вигляді туману в легені. Виробляє частинки, менші за 5 мікрон у діаметрі. Використовується при астмі, респіраторних хворобах та в інших випадкахЦе лікування вже здобуло схвалення від Американської адміністрації з питань харчових продуктів і медикаментів для лікування рідкісних захворювань (так званих орфанних). Скоріш за все, це лише початок нової ери у медицині та біології. Але шлях до неї був довгим та сповненим поневірянь.